Suite à la comparaison des recettes de lessives DIY et de leurs efficacités, j'ai voulu comprendre plus précisément la composition et le rôle des différents ingrédients d'une lessive afin de pouvoir améliorer celle que j'utilise.
J'ai donc potassé pas mal de publications, et je vous livre ici mes conclusions.
👉 Sautez direct aux résultats si vous voulez éviter le blabla et lire directement les essais pour améliorer la lessive !
Qu’est-ce que le lavage du linge ?
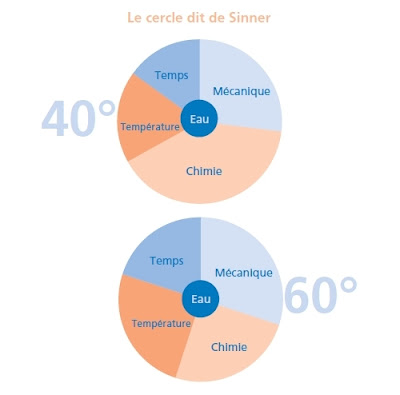
Le lavage est un processus complexe qui met en jeu 4 principaux facteurs : le temps, le travail mécanique, la chimie et la température. La combinaison des quatre facteurs intervient par l‘intermédiaire de l‘eau et garantit le résultat de lavage souhaité.
Si un facteur est modifié, ceci doit être compensé par un autre facteur pour atteindre le même résultat. On représente ces relations dans le cercle dit « de Sinner ». Si par exemple la température de lavage est réduite, le pouvoir de lavage est de ce fait diminué et peut être compensé par un apport de chimie, un travail mécanique plus élevé ou un temps de lavage prolongé.
Le lavage se déroule en trois étapes :
- L’eau mouille les fibres et la saleté
- La saleté est détachée des fibres : il existe différents modes d’action, efficaces sur différents types de taches, qui sont appliqués par différents types d’ingrédients. Ces processus sont : chimiques (saponification, oxydation), physico-chimiques (rolling-up, solubilisation, micellisation, émulsification), physiques (fluorescence) ou biochimiques (dégradation enzymatique)
- La saleté est évacuée avec l’eau
De quoi dépend l'efficacité d'une lessive ?
De plusieurs facteurs dont les principaux sont :
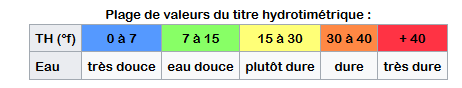
- La dureté de l’eau : C'est ce qu'on appelle le titre hydrotimétrique (TH), dont l’unité est le degré français : °f – et non pas °F (degrés Fahrenheit). Dans d'autres pays, on utilisera également le degré anglais, le grain américain et le degré allemand ou °dH. le TH indique la teneur globale en sels de calcium et magnésium qui sont responsables de la dureté de l'eau dans la plupart des eaux naturelles. Généralement le calcium contribue au TH dans la proportion de 70 à 90%. Les détergents tels que le savon sont moins efficaces dans une eau dure : les ions calcium (Ca2+) et magnésium (Mg2+) font précipiter les tensioactifs du savon ce qui l’inactive et forme un dépôt néfaste (écume de savon) sur les tissus et dans la machine. Vous pouvez connaitre la dureté de l'eau de votre commune sur internet via la plateforme solidarites-sante.gouv.
- La température de lavage (Qui joue un rôle énorme sur l’efficacité des ingrédients de la lessive et la solubilité des tâches
- Le type de salissures : grasses (graisses, cosmétiques, hydrocarbures), maigres (thé, vin, herbe, fruits, encre), particulaires (terre, poussière, suie) et corporelles (sébum, transpiration, sang)
- Le type de tissus (cotons, synthétique…)
Quels sont les ingrédients d’une lessive industrielle et leurs rôles ?
Une lessive industrielle est composée de plusieurs types d’ingrédients avec des fonctions particulières, détaillées ensuite :
- Tensioactif ( = agent de surface)
- Adjuvants (= chélatant, séquestrant, complexants, anticalcaires, builders)
- Agents de blanchiment (oxydants, pour les tâches maigres)
- Des régulateurs de pH
- Des enzymes
- Des azurants optiques (= effet blanc du linge)
- Des parfums
- D'autres substances (sels, produits complexant, anti décoloration, ...)
La lessive Ariel publie la liste de ses principaux ingrédients sur son site enviedeplus, associé à leur fonction principale.
Tensioactifs (ou "agents de surface")
Ils assurent le décollement des salissures (rôle détergent) et leur maintien en suspension (rôle émulsifiant). Ils ont aussi un rôle de "mouillant" c'est à dire qu'ils vont permettre à la lessive et à l'eau de mieux pénétrer les tissus pour aller les nettoyer en profondeur.
Une molécule tensioactive se compose d’une extrémité qui attire l’eau (hydrophile) et d’une autre extrémité hydrophobe qui attire les graisses. Au cours du lavage, cette dernière fixe les saletés contenant des graisses pendant que la partie hydrophile reste « collée » à l’eau, et assure l’évacuation du tout avec l’eau de lavage.
| Image : Champougny, Lorène. (2015). Generation and rupture of thin liquid films |
Les agents tensioactifs se répartissent en quatre groupes :
- les tensioactifs anioniques : partie hydrophile chargée négativement. C'est la catégorie la plus nombreuse et la plus utilisée dans les lessives. Ils sont utilisés comme détergents, agents moussants, humectants, dispersants, mouillants et comme actifs bactériostatiques (= inhibent la multiplication des bactéries sans les tuer). Le savon en fait partie, c’est le carboxylate de sodium, mais il est très peu utilisé. Ils sont sensibles à la dureté de l’eau. Un autre couramment utilisé est par exemple le décrié lauryl sulfate de sodium (SLS).
- Les tensioactifs cationiques : partie hydrophile chargée positivement. Ce ne sont ni bons détergents, ni bons agents moussants mais de bons dispersants des particules solides. Bons bactéricides ou bactériostatiques, ils sont employés dans les désinfectants médicaux, industriels ou domestiques. Ce sont aussi des agents antistatiques et adoucissants pour le textile et les cheveux. (ex : ammonium quaternaires)
- Les tensioactifs amphotères : ils possèdent à la fois une charge électrique positive et une charge négative, et la charge globale est nulle. Peu irritants, sont largement employés dans les produits cosmétiques et pharmaceutiques. (ex : phospholipides)
- Les tensioactifs non ioniques : la molécule ne comporte aucune charge. Faiblement toxiques, ils sont employés en cosmétique et en alimentaire comme détergents, agents mouillants, émulsifiants et parfois moussants. (ex: esters de glycol ou de glycérol, alcools)
Généralement plusieurs tensioactifs sont associés pour une meilleure efficacité. On associe beaucoup les non ioniques et les anioniques dans des proportions qui varient entre 1/4 et 2/3 car les premiers permettent de prévenir la précipitation des seconds au contact des ions calcaires (en formant des complexes entre eux, qui ne réduisent pas leurs efficacité). Cette association permet aussi de réduire la mousse, ce qui est intéressant pour le lavage en machine, et améliore le nettoyage des corps gras. Les tensioactifs anioniques et cationiques en revanche ne s'entendent pas : mis ensemble, ils précipitent, ce qui les neutralise.
En Europe, dans les lessives, on ajoute des anti-mousses mais ce n'est pas le cas au US ou au Japon, car leurs machines sont plus tolérantes. Ces anti-mousses sont souvent des savons ou silicones (les savons sont tellement sensibles au calcaire qu'on les utilise plutôt pour le neutraliser que comme détergent!).
Les tensioactifs sont presque toujours associés à ce qu'on appelle des "builders", ou des "adjuvants", pour améliorer leur efficacité, notamment en les préservant de la dureté de l'eau et en leur donnant des conditions de travail idéales.
Le sel d'Epsom (sulfate de magnésium) est aussi présent dans certaines lessives industrielles (listé dans le document sur les ingrédients de Ariel par exemple) et indiqué comme adoucissant et comme tensio-actif. Il est mentionné dans un brevet de lessive concentrée (Ultra concentrated liquid laundry detergent) comme améliorant la dispersion de la lessive à basse température (à une concentration de 2%, ou entre 0,5% et 6% selon les cas) et il est présent dans les ingrédients donnés par Ariel (comme aide au nettoyage) mais je n'ai trouvé que peu d'information à ce sujet.
🌍Aspect écologique : Les effets environnementaux des tensioactifs ont été pointés du doigt il y a quelques années, et sont toujours mis en cause pour leur écotoxicité et leur présence répandue dans les eaux. Ils ont été notamment accusés de dégrader les littoraux, et d'altérer la division cellulaires des petits organismes. Depuis une règle de biodégradabilité ultime minimale de 60% en 28 jours a été mise en place (mais donc il en reste tout de même).
De plus, certains peuvent être irritants ou toxiques pour l'homme, comme le répandu Sodium Lauryl Sulfate (SLS) par exemple, si irritant qu’il est devenu une référence pour les tests de tolérance cutané.
Globalement mieux vaut éviter les dérivés du pétrole et privilégier les tensioactifs biodégradables, doux et d'origine naturelle (cherchez les termes "glutamate" ou glucosil"; bien que le détail des tensioactifs utilisé soit souvent caché par la mention globale "agents de surface")
👉 Plus d'info sur quels tensioactifs sont à privilégier / éviter sur le site de biolineaires.
Les adjuvants (complexant, échangeurs d'ions,...)
Ils neutralisent le calcaire pour éviter, entre autre, l’inactivation des tensioactifs (qui se complexifient avec les molécules de calcaire et deviennent inefficaces).
- Des matériaux alcalins précipitants comme le carbonate de sodium et le silicate de sodium qui vont précipiter les ions en calcaire (CaCO3). La précipitation du calcaire par le carbonate de soude peut induire un dépôt sur le linge et dans la machine à laver, c'est pourquoi ils sont souvent associés à des complexants.
- Des agents complexant, qui vont s'associer et isoler ions calcaires. C’était à l’époque l’un des rôles des phosphates. Ces derniers sont interdits depuis 2007 en France, car très néfastes pour l’environnement : ils provoquent l’eutrophisation des milieux (= une sorte d’asphyxie) à cause de la libération de phosphore. Ils sont généralement remplacés par phosphonates dans les lessives liquides. On retrouve aussi les citrates dans cette catégorie, dont le citrate de sodium et l'acide citrique. Ils sont très utilisés dans les lessives liquides.
- Des échangeurs d'ions, qui vont remplacer les ions Ca2+ et Mg2+ par des ions sodium (Na+). Parmi les plus utilisés on retrouve les zéolites (des alumino-silicates, des minéraux naturels insolubles dans l’eau). Elles sont généralement jointes à des carbonates (par exemple carbonate de sodium), des citrates, d'autres silicates, ou des polycarboxylates (dérivés du pétrole). Les silicates et les carbonates peuvent être associés pour de meilleurs résultats et moins de génération de sédiments, et dont moins d'impact sur le traitement des eaux ensuite. Les citrates sont moins efficaces dans les lessives liquides que dans les poudres car ils précipitent (phénomène de relargage).
Les silicates, y compris les argiles, font l'objet de nombreux brevets, et certains ont des propriétés détergentes, anticorrosives, anti-redéposition, anti-agglomérants, texturants (pour les liquides), et si ils sont peu efficaces comme adoucissants en eau douce, ils sont en revanche très efficaces en eaux dures (surtout les silicates amorphes).
Parmi les silicates, on retrouve donc la zéolite (très utilisée, elle fait l'objet de nombreux brevets), mais aussi les silicates de sodium (beaucoup brevetés aussi), dont la bentonite (présente chez Ariel par exemple), une argile verte composée principalement de montmorillonite, qui aurait la propriété de capter les graisses et les protéines.
La bentonite fait l'objet de plusieurs brevets (Dont Palmolive en 1986 et en 1984) ou d'autres encore, ou même plus récemment, pour des propriétés adoucissantes sur le linge dans les détergents.
Les différentes bentonites du marché peuvent cependant avoir des capacité d'adoucissement très diverses, allant de nulles à très bonnes, comme le montre le tableau en page 18 de ce brevet de 1977:
On peut par ailleurs retrouver dans ces brevets la composition des lessives. Si on regarde le brevet palmolive de 1986 par exemple), la teneur en Bentonite indiquée va de 0.5 à 10% . Si on regarde celui de 1984, on peut voir que la bentonite monte jusqu'à 12% de la composition de la lessive :
Source : Ramachandran, Pallassana N. (Robbinsville, NJ), Peterson, Kenneth S. (Keasbey, NJ) 1984 Fabric softening heavy duty liquid detergent containing a mixture of water insoluble soap and clay United States Colgate-Palmolive Company (New York, NY)
L’efficacité adjuvants décroit avec l’augmentation de la température de lavage, comme on peut le voir dans la publication "Laundry Detergents" de E. Smulders (2007) :
| Source : Smulders, E., von Rybinski, W., Sung, E., Rähse, W., Steber, J., Wiebel, F. and Nordskog, A. (2007). Laundry Detergents. In Ullmann's Encyclopedia of Industrial Chemistry, (Ed.) |
🌍Aspect écologique : Les phosphonates ne se dégradent que lentement par voie biologique, et sont en grande partie évacués avec les boues d’épuration (qui doivent être brulées). Certaines études montrent que les phosphonates sont biodégradables sous l’action des rayons UV mais ils libèrent alors du phosphore qui participe de l’effet d’eutrophisation (mais tout de même moins que les phosphates).
Constituées de minéraux naturels insolubles, les zéolites ne peuvent se décomposer, et se déposent dans les sédiments des cours d’eau et des lacs, mais aussi dans les boues des stations services. Elle viennent donc augmenter la quantité des boues de stations d'épuration à traiter (incinérer). Leur association avec des carbonates (par exemple silicate de sodium + carbonate de sodium) semble permettre de réduire cet impact.
Les polycarboxylates sont issus du pétrole et se caractérisent par leur lente biodégradabilité et doivent être brulés avec les boues des stations d’épuration. Les citrates se dégradent vite et bien dans la nature. Les silicates sont constitués de matières premières naturelles que sont le sable, la potasse et la soude. Ils sont un composant naturel de notre environnement – ils constituent plus de 80% de la croûte terrestre. Après leur utilisation industrielle, les silicates sont rendus à leur cycle naturel. La soude devient un composé inerte et non polluant (c'est de la craie).
Les agents de blanchiment
Ils décolorent les tâches maigres colorées (peu sensibles aux tensioactifs) en les oxydant durant le lavage.
Les premiers agents de blanchiment utilisés ont été les produits chlorés, comme l’eau de javel dans les années 30. Cependant, bien qu’efficaces à basse température et à faible concentration, les produits chlorés sont à l’origine de réactions secondaires car ils oxydent également les colorants, les azurants optiques et certains textiles eux-mêmes, en plus d'être nocifs pour la santé et l'environnement.
Aujourd’hui, les agents de blanchiment les plus utilisés sont le perborate et le percarbonate de sodium, des composés capables de libérer de l’oxygène au contact de l'eau, et plus précisément de l’eau oxygénée (peroxyde d’hydrogène). Le peroxyde va venir oxyder les tâches maigres et les faire disparaitre.
Toutefois, l’eau oxygénée seule n’est pas efficace à des températures inférieures à 60 °C. Il est donc nécessaire de l’utiliser en combinaison avec un activateur, qui va lui permettre de prendre la forme d’un peracide, plus efficace à basse température. Ces activateurs sont généralement du tétraacétyl éthylène diamine (TAED), qui conduit à la formation d’acide peracétique ou du nonanoyloxybenzène sulfonate de sodium (NOBS), qui conduit à de l’acide pernonanoïque.
Les agents de blanchiment ne peuvent être utilisés que dans les lessives en poudre car l'eau oxygénée est instable, de nombreuses substances provoquent sa dégradation en eau et en oxygène (sels, impuretés, chaleur, lumière) donc si ces produits sont ajoutés dans la lessive liquide, ils seront assez rapidement dégradés et donc inefficaces. Ils ont la capacité d'augmenter le pH de la solution en même temps que leur action oxydative.
Le percarbonate de sodium n’est pas stable dans une lessive en poudre contenant des zéolites (à cause de l'humidité et de métaux apportés par la zéolite) sauf si il est encapsulé ou que le taux d'humidité est extrêmement faible.
🌍 Aspects écologiques : Le perborate va produire du borate et de l'oxygène en se dégradant. Le borate n’est pas éliminé dans les stations d’épuration et atteint les eaux de surface, qui contiennent déjà une certaine quantité de bore. En quantité importante ce composé est toxique pour les plantes. Le perborate possède des effets néfastes sur le fertilité (Fiche 15120-21-5 de l'INRS).
Le percarbonate de sodium, lui se décompose en cristaux de soude, qui est sont non polluants. Les activateurs comme le TAED sont souvent toxiques et peu biodégradables mais j’ai trouvé assez peu de détails sur leur impact environnemental.
Les régulateurs de pH
Ils permettent d’augmenter le pH afin d’aider au retrait des salissures grasses. Avoir un agent alcalin permet en effet de… saponifier les corps gras des tâches et donc de les rendre solubles (Lors d’une machine, on fait donc du savon avec les tâches grasses !). Ils provoquent un léger gonflement des fibres, augmentant aussi le pouvoir nettoyant de la lessive. Ils contribuent également à assurer une fine dispersion des particules de saleté dans le bain de lavage et fixent les sels ferriques dissous dans l’eau, ce qui préserve le linge du jaunissement et prévient la corrosion. Parmi les agents alcalins on retrouve à peu près tout ce qui va abaisser le pH d'une solution. On peut citer les produits de soude (silicates, cristaux de soude, percarbonate, bicarbonate).
Le pH idéal pour une bonne détergence et une bonne complexation des ions calcaires est entre 9.5 et 10. il faut donc essayer de maintenir le pH de la lessive dans ce scope. (D'après Louis Ho Tan Hai)
Certains sites proposent aussi des recettes (et notamment des lessives DIY "écolo" à base de Borax comme le site zerowasteswitzerland). Attention cependant, ce produit n'est pas anodin, il est toxique pour l'homme et pour l'environnement.
🌍 Aspect écologique : Les silicates, comme le verre, résultent de la fusion du quartz et de la soude. La croûte terrestre se compose à 95% de silicates. Les autres produits de la soude se dégradent aussi en composés inertes. Les silicates ou la soude n’ont pas d’effets préjudiciables sur l’environnement.
Le borax par contre va donner de l'acide borique et du borate. Le borax et l'acide borique ont des effets néfastes sur la fertilité et le développement des embryons (décrits par l'INRS - Institut national de recherche et de sécurité pour la prévention des accidents du travail et des maladies professionnelles).
Les enzymes
Les enzymes sont comme des petits outils, des petits ciseaux, souvent trouvées dans les tubes digestifs des êtres vivants. Elles sont chacune leur spécialité (protéines, cellulose, amidon…) et s’attaquent aux salissures organiques : boissons, sauces, légumes, sang… qu’elles rendent plus accessibles aux tensioactifs en les découpant. Leur activité est maximale à 40°C et elles deviennent inactives au-delà de 60°C. Leur présence n’a donc d’intérêt que pour les lavages à températures réduites. Mieux éviter de laver le linge délicat avec (surtout laine et soie qui sont d’origine animales) car les enzymes pourraient s’y attaquer aussi.
🌍 Aspects écologiques : L’utilisation d’enzymes ne constitue pas un problème pour l’environnement.
Les azurants optiques
Ce sont des matériaux qui eux-mêmes sont incolores. Contrairement aux agents de blanchiment chimiques qui par libération d‘oxygène dans la solution de lavage peuvent blanchir des taches – il s‘agit ici d‘un « blanchiment physique ». Les azurants optiques transforment la portion ultraviolette invisible de la lumière du jour en lumière bleuâtre visible. Le tissu reflète donc plus de lumière bleue qu’il n’en reçoit (C’est comme si on lui avait rajouté une touche de bleu) : les textiles incolores apparaissent plus blancs et les tissus multicolores plus gais. Leur action s’apparente un peu à accentuer la saturation d’une photo. Pour le linge fin, les azurants risquent d’altérer certaines couleurs.
🌍 Aspects écologiques : Ce sont des composés organiques complexes obtenus à partir de dérivés du pétrole. Certains experts experts indiquent que les azurants optiques sont sans inconvénient étant donné qu‘ils sont peu stables dans l‘environnement en présence de lumière solaire et d‘eau et qu‘ils sont dégradés par la lumière (photodégradation). Il n’existe pas d’étude sur l’impact des azurants non dégradés, qui sont déposés dans les sédiments.
Les astuces de grand-mères :
Le blog Lespiedsdanslatoile donne aussi l'astuce de mettre 8 gouttes d'encre de stylo bleu dans le bac d'adoucissant (bleu de méthylène), ou alors 1/6 de craie bleue d'écolier.
Madame Chassetaches donne les astuces suivantes pour blanchir du linge, mais je n'ai rien vérifié :
- Ajouter à votre lessive 60 ml à 125 ml (1/4 à 1/2 tasse) de bicarbonate de soude ou de borax.
- La lessive retrouvera aussi sa blancheur si vous ajoutez un sac noué contenant des coquilles d’œufs vides, propres et brisées en morceaux grossiers et quelques tranches de citron.
- Se rappeler que le citron et le soleil sont deux précieux alliés pour faire blanchir les vêtements. Adoptez la corde à linge pour votre brassée de blanc.
Les parfums
Ils couvrent l’odeur désagréable des lessives et donnent une odeur au linge.
🌍 Aspects écologiques : Selon leur composition, ils peuvent contenir des phtalates et des muscs, et d’autres substances polluantes. Ils peuvent parfois causer des allergies.
Les autres additifs
- Les sels neutres (sulfate de sodium, chlorure de sodium... etc) : Pour les lessives en poudre, ils favorisent le bon écoulement de la poudre en l’empêchant de s’agglomérer et de former de la poussière. Pour les lessives liquides, ils peuvent servir à ajuster la viscosité. Ariel les mentionne comme anti-calcaires mais je n'ai pas trouvé pourquoi.
- Les agents anti-redéposition : Ils maintiennent en suspension dans le bain de lessive la saleté dissoute et l’empêche de se redéposer sur le linge. C'était aussi l'un des rôles des phosphates, et c’est maintenant notamment celui de la CMC (carboxyméthylcellulose) : cellulose extraite des déchets de bois. La cellulose est le composé organique de loin le plus répandu dans la nature, puisqu’elle constitue la quasi-totalité des parois cellulaires des tissus végétaux vivants ou morts. Il est intéressant de noter que l'incrustation des minéraux dans les tissus (redéposition) augmente avec la température.
- Protection contre la décoloration (Anti-chaussettes roses) : Le PVP (polyvinylpyrrolidon) ou le PVI (polyvinyimidazol) peut fixer les particules de couleur détachées des fibres et éviter qu‘elles ne se redéposent sur le linge et provoquent une décoloration non souhaitée. Les matériaux d’origine de ces substances sont entre autres l‘acétylène et l‘ammoniac. En cas de décoloration, Madame chasse tache propose une astuce de grand-mère très intéressante : "Si la couleur (souvent rosée) a été transmise par un autre vêtement coloré, faites tremper le vêtement taché dans un bol de lait 2% ou 3.25%. Couvrez complètement le vêtement de lait. Ce détachage nécessitera peut-être 2 ou 3 litres de lait, mais vous pourrez récupérer le vêtement après quelques heures de trempage."
- Les stabilisateurs : Ils visent à assurer la stabilité de l’agent de blanchiment, et à éviter les dépôts de calcaire sur le linge. Les phosphonates sont les principaux stabilisateurs entrant aujourd’hui dans la composition des lessives. L’EDTA utilisé autrefois a perdu toute son importance.
🌍 Aspects écologiques : Les sels font partie intégrante des eaux naturelles. Les quantités de ces substances rejetées dans nos cours d’eaux par les eaux de lessive n’accroissent que très modestement (moins d’un pour cent) leur charge totale en sels. La CMC est un produit à biodégradabilité lente. On ne lui connaît toutefois pas d'effet préjudiciable sur l’environnement. Le PVP est utilisé depuis de nombreuses années dans le domaine des technologies alimentaires, pharmaceutiques et cosmétiques. En comparaison, son emploi dans les lessives est minime. D’après certains, il ne soulève aucune réserve du point de vue écologique.
Petite parenthèse sur le mélange vinaigre + bicarbonate
Sa seule action "efficace" prouvée dans le nettoyage est la réaction effervescente (c'est donc l'action physique, et non chimique, qui est utile).
Une fois la réaction chimique terminée, on a du dioxyde de carbone (CO2); de l'eau, et de l'acétate de sodium.
Le CO2 s'est majoritairement enfui dans l'air (d'où l'effervescence) donc en gros il reste de l'eau et de l'acétate de sodium. (Ainsi que du bicarbonate ou du vinaigre, selon celui qui était en excès dans la solution initiale, sauf si c'était parfaitement dosé).
L'acétate de sodium n'est pas reconnu pour des propriétés nettoyantes, au contraire de ses deux parents pris individuellement. C'est donc du gaspillage de faire une solution nettoyante mélangeant ces deux produits à l'avance, car ils vont se neutraliser. Si votre produit fonctionne, c’est surement que le mélange a été mal dosé et qu'il reste du vinaigre ou du bicarbonate.
L'effervescence est en revanche utile pour déboucher les canalisation et détacher des surfaces très grasses. Mais elle est complètement inutile dans une lessive préparée à l'avance.
Quel rapport avec ma lessive maison?
La lessive DIY que j'utilise est à base de savon (c’est son principal tensioactif). Même si c'est la plus efficace des lessives DIY que j'ai testé (comparatif sur cette page), et qu'elle me convient plutôt bien, j'aimerai l'améliorer car je lui trouve les défauts suivants :
- Des mauvaises odeurs sur mon linge (genre vomi)
- Des dépôts dans ma machine à laver
- Une efficacité partielle sur les tâches grasses et corporelles
Ces défauts pourraient tout à fait être expliqués par la sensibilité du savon à la dureté de l'eau. Les molécules de savon s’associent avec les molécules de calcaire (ions calcium et magnésium) et forment de l’écume de savon ("soap scum") qui a tendance à s'accumuler sur les tissus et les pièces de machine à laver.
Une telle accumulation réduit le pouvoir absorbant des tissus et leur perméabilité à l'air, et finalement, par "vieillissement", le linge se décolore et peut développer des mauvaises odeurs. De plus, cela vient inactiver une partie du savon de la lessive et donc réduire ma quantité de tensio-actifs.
Autrefois le savon représentait jusqu’à 40% des tensioactifs, mais avec l’arrivée des tensioactifs de synthèse et à cause de sa sensibilité à l’eau dure, son utilisation a grandement réduit. Il est aujourd’hui plus utilisé dans les lessives comme adjuvant anti-mousse et anti calcaire que comme tensioactif.
De plus je souhaite aussi m'assurer que mon linge ne va pas grisailler, surtout les draps que j'utilise pour les locations saisonnières (j'ai peu d'habits blancs). Les voyageurs apprécient des draps bien blancs, ca fait tout de suite plus propre et plus qualitatif.
Alors, comment améliorer ma lessive maison ?
Il me semble qu'une bonne façon d'améliorer l'efficacité de ma lessive serait de neutraliser le calcaire de mon eau (eau plutôt dure avec un TH de 26°C environ). Cela éviterai aux ions calcium et magnésium de s’agglomérer avec le savon et de former l'écume de savon, donc j'aurais moins de dépôt, mon linge serait plus souple et les odeurs disparaitraient peut-être.
Pour les tâches grasses, le résultat pourrait être amélioré par un pH basique qui permettrait leur saponification / solubilisation.
Pour le blanchiment, je peux tout à fait le faire "à part" de la lessive, au cas par cas, en ajoutant du percarbonate dans le tambour par exemple.
Si je fais un bilan des ingrédients que je considère écologiques de la lessive industrielle, et notamment ceux que je souhaite garder (en gras):
- Tensioactif => C'est mon nettoyant
- Savon
- Sel d'Epsom
- Adjuvants => J'en ai besoin pour éviter l'inactivation de mon savon et la formation d'écume de savon. J'ai à ma disposition :
- Silicates (Zéolite, Bentonite - J'ai envie de tester)
- Citrates (ex : citrate de sodium, acide citrique)
- Bicarbonate de soude
- Cristaux de Soude
- Agents de blanchiment => Non compatible avec le format liquide de ma lessive
- Des régulateurs de pH => Je souhaite en avoir pour améliorer l'efficacité de nettoyage. Je peux utiliser des composés alcalins :
- Produits de la soude (bicarbonate, cristaux de soude)
- Des enzymes => Je m'en passe
- Des azurants optiques => Je les remplace par des agents de blanchiment pour leur rôle (maintient du blanc) ou par des astuces de grand-mère. Il existe :
- Percarbonate de soude
- Acide citrique (+ soleil)
- Bleu de méthylène (encre de stylo bille)
- Craie bleue (en plus ca peut jouer le rôle de régulateur de pH)
- Des parfums => Je m'en passe. Les huiles essentielles dans la lessive, ca ne marche pas et ce n'est pas non plus très recommandé à cause des COV (composés organiques volatiles).
- D'autres substances (sels, produits complexant, anti décoloration, ...) => Je m'en passe
👉 Il me faut donc neutraliser le calcaire et augmenter le pH
Je peux choisir d'installer un adoucisseur sur ma maison, mais ce n'est pas le plan. J'ai des balles de lavage magnétiques mais cela ne semble pas suffire. Je souhaite tester une neutralisation du calcaire directement dans ma lessive.
Quand on souhaite se débarrasser du calcaire, on pense tout de suite au vinaigre. Cependant, cela acidifierait le bain lessiviel (le pH du vinaigre est aux alentours de 2.4) or je souhaite améliorer le détachage des tâches grasses et donc je voudrais plutôt avoir un pH basique et être autour de 9 - 10.
Ce que j'envisage est la précipitation des ions calcaires. Il me faut donc des composés alcalins, et je choisis les cristaux de soude (carbonate de sodium) qui vont me permettre de précipiter les ions et d'augmenter mon pH. Je souhaite aussi ajouter du sel d'epsom (car j'en ai et qu'il semble intéressant), ainsi que de l'argile. Et bien sur, du savon.
Quelles quantités pour mes ingrédients?
Petit rappel d'un exemple de formule brevetée de chez Palmolive:
Source : Ramachandran, Pallassana N. (Robbinsville, NJ), Peterson, Kenneth S. (Keasbey, NJ) 1984 Fabric softening heavy duty liquid detergent containing a mixture of water insoluble soap and clay United States Colgate-Palmolive Company (New York, NY)
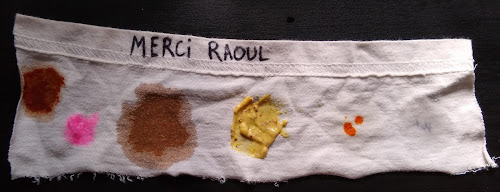
Et composition de la recette de lessive DIY de merci Raoul que j'utilise :
- 30 grammes de savon de Marseille (soit 2%)
- 1 cuillère à soupe de bicarbonate de soude (Soit environ 15g pour 1.5L soit 1%)
- 1 litre et demi d'eau
Les tests de recettes de lessives améliorées :
Les résultats se feront aussi voir sur la durée et ne seront surement pas probants en un seul lavage (notamment le dépôt et les odeurs)
Pour rappel voici les résultats de lavage obtenus avec un lavage à l'eau sans lessive, et avec la recette initiale de Merci Raoul :
Recette 1 (lavage à 30°C):
- Savon : 20g (Je choisi de conserver la quantité de savon que me propose la recette de Raoul car je la trouve satisfaisante. Il y a 30g pour 1.5 litres d'eau, soit 20g pour 1 litre.)
- Sel d'Epsom : 20g (Le brevet mentionné recommande environ 2% de sel d'Epsom, c'est donc ce que je choisis)
- Cristaux de soude : 50g (La formule brevetée de Palmolive citée précédemment contient 4% de cristaux de soude. Si je calcule combien de soude il faut pour dissoudre la quantité de calcaire de mon eau (voir plus bas le détail*) j'arrive à une quantité de 4.5% ce qui correspond à peu près. Je veux qu'il reste de la soude pour augmenter le pH de mon lavage aussi je décide de mettre 5%)
- Argile : 30g (Je décide aussi d'ajouter de l'argile verte parce que j'en ai a disposition, que j'ai déjà pu croiser une ou deux recettes qui en contenaient, et parce que le brevet de palmolive a déposé sur la bentonite m'a donné envie de tester. Dans leur formule (voir précédemment) ils en incluent de 0.5 à 12%, et ils indiquent des conditions (tailles entre 200 et 1000 microns, type particulier, etc). Je vais faire simple et utiliser l'argile verte que j'ai sous la main), et j'en met 3% comme recommandé dans l'un de leur brevets.
- Eau : 1L
Les cristaux donnent du bicarbonate en se désagrégeant donc je ne rajoute pas de bicarbonate.
Cela fait beaucoup d'argile, la lessive est carrément verte et j'ai l'impression qu'elle colore un peu le tissu au lavage (le blanc semble terni). L'efficacité n'est pas meilleure qu'avec la lessive de Raoul sur les tâches.
Par contre au toucher, le tissu semble bien plus souple, plus doux (alors que je n'ai pas ajouté d'adoucissant) qu'avec la lessive de Raoul et qu'avec l'eau.
Recette 2 (lavage à 30°C):
- Savon : 20g (Je choisi de conserver la quantité de savon que me propose la recette de Raoul car je la trouve satisfaisante. Il y a 30g pour 1.5 litres d'eau, soit 20g pour 1 litre.)
- Sel d'Epsom : AUCUN
- Cristaux de soude : 50g (La formule brevetée de Palmolive citée précédemment contient 4% de cristaux de soude. Si je calcule combien de soude il faut pour dissoudre la quantité de calcaire de mon eau (voir plus bas le détail*) j'arrive à une quantité de 4.5% ce qui correspond à peu près. Je veux qu'il reste de la soude pour augmenter le pH de mon lavage aussi je décide de mettre 5%)
- Argile : AUCUN
- Eau : 1L
Je cherche à savoir si l'effet "douceur" vient de l'argile et/ou du sel (je testerai aussi avec l'un et l'autre des ingrédients), et si les retirer réduit cet effet ou l'efficacité de la lessive (car ils coutent cher dans la recette)
En cours de test
Et pour blanchir mon linge ?
Il vaut mieux éviter de mettre des agents blanchissants pour les couleurs car cela peut faire griser le linge.
Pour le blanc, si je souhaite ajouter du percarbonate de sodium, il ne me sert à rien de le mettre pour des machines de moins de 60°C (soit la majorité de celles que je fais). De plus, il ne sert pas de l'incorporer dans la lessive liquide, car il s'active dès contact avec l'eau et donc ne fera plus effet après une période de stockage.
Mieux vaut le mettre directement dans le tambour de la machine pour les blancs que je souhaite « blanchir » et dans ce cas mettre un programme à 60°C au moins. De toute façon, c’est presque uniquement le linge de maison que je dégrise (on a peu d’habits blanc), donc je le lave à 60°C pour le désinfecter.
________________________________
*Détail du calcul de la quantité de cristaux de soude nécessaire à la neutralisation du calcaire de mon eau :
Les ions calciums dans l'eau sont présents majoritairement sous la forme bicarbonate Ca(HCO3)2.
Si je rajoute du carbonate de sodium (Na2CO3) à l'eau pleine d'ions calcium, j'obtiens alors du calcaire précipité et du bicarbonate de soude :
Ca(HCO3)2 + Na2CO3 → CaCO3 + 2NaHCO3
J'utilise donc un ion calcium pour une molécule de carbonate. Comme une molécule de calcaire s'associe à une molécule de carbonate au niveau molaire je dois avoir la même quantité des deux (en moles puisque c'est ainsi qu'on pèse les molécules)
La masse molaire des molécules de calcaire est de 100 g/mol et celle du carbonate de calcium est de 106 g/mol. Je sais que mon eau possède un TH de 25.8°f, or 1°f = 10mg/L de CaCo3. Cela signifie que dans mon eau j'ai environ 258 mg/L de calcium, soit 258g/m3. La masse molaire étant de 100, cela me donne 258/100 = 2.58 moles. Il me faut donc 2.58 moles de carbonate. La masse molaire de 106 me donne 2.58*106 = 273g/m3, soit 273 mg/L de carbonate à ajouter.
Si je considère qu'une lessive c'est environ 10L d'eau, cela me fait 2.7g de carbonate de soude à ajouter par lessive. J'utilise environ 60g de lessive pour un lavage, je dois donc ajouter au moins 45g de soude par litre de lessive (soit 4.5%).
Références
- Ariel; Les ingrédients de votre lessive Ariel ; 2020; https://www.enviedeplus.com/maison/lessive/les-ingredients-de-votre-lessive-ariel
- Biolineaires; Détergence écologique – Comprendre la biodégradabilité; 2008; https://www.biolineaires.com/detergence_ecologique__comprendre_la_biodegradabilite/
- Consoglobe; Peut-on mélanger le vinaigre blanc et le bicarbonate de soude ? ; 2019; https://www.consoglobe.com/melanger-vinaigre-bicarbonate-cg
- INRS; Fiche toxicologique n° 287 : Tétraborate de disodium Borax; http://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_287
- INRS; Fiche toxicologique n° 138 : Acide Borique Borax; http://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_138
- INRS; Fiche Demeter 126 : Perborate de Sodium; Fiche 15120-21-5; http://www.inrs.fr/publications/bdd/demeter/demeter-CAS.html
- Les pieds dans la toile; liquide, poudre, blanc, couleurs, delicat, bien choisir sa lessive; 2011; http://www.les-pieds-dans-la-toile.fr/2011/10/liquide-poudre-blanc-couleurs-delicat-bien-choisir-sa-lessive/
- Les pieds dans la toile; La lessive a chaud parfois c'est mieux; 2012; http://www.les-pieds-dans-la-toile.fr/2012/02/lessive-a-chaud-parfois-cest-mieux/
- Madame Chasse taches; Toujours plus blanc; 2011; https://www.madamechassetaches.com/2011/09/toujours-blanc/
- Ministère des solidarités et de la santé : Qualité de l'eau potable. https://solidarites-sante.gouv.fr/sante-et-environnement/eaux/eau
- Nardello-Rataj et al., Les lessives en poudre : Un siècle d’innovations pour éliminer les taches (2003). (https://lycee-champollion.fr/IMG/pdf/les_lessives_en_poudre-2.pdf)
- SIBA (Syndicat intercommunal Bassin d'arcachon); Rapport d’étude : Les tensioactifs; 2020; https://www.siba-bassin-arcachon.fr/sites/default/files/2020-04/2020_SIBA_TENSIOACTIFS.pdf
- SKW (Association suisse des cosmétiques et des détergents); La lessive aujourd‘hui : Informations sur le thème de la lessive et de la protection de l‘environnement; 2010; http://www.les-pieds-dans-la-toile.fr/wp-content/uploads/2011/10/la_lessive_skw_2010.pdf
- Smulders, E., von Rybinski, W., Sung, E., Rähse, W., Steber, J., Wiebel, F. and Nordskog, A. (2007). Laundry Detergents. In Ullmann's Encyclopedia of Industrial Chemistry, (Ed.)
- Tan Hai Ho Louis, Formulating Detergents and Personal Care Products: A [complete] Guide to Product Development (2000); AOCS Press, 465 pages
- UAE (Union Française des professionnels du traitement de l'eau); Différences entre pH, TH, et TAC; 2013; https://uae.fr/wp-content/uploads/2016/08/18-DIFFERENCE_ENTRE_pH_TH_ET_TAC_V3_OCT_13.pdf
- UFC Que Choisir; Produits cosmétiques : Les fiches des molécules toxiques à éviter; 2019; https://www.quechoisir.org/decryptage-produits-cosmetiques-les-fiches-des-molecules-toxiques-a-eviter-n2019/#sodium-lauryl-sulfate-ammonium-lauryl-sulfate
- Patent: Weinstein, Barry M. (Old Bridge, NJ) 1988 Fabric softening bentonite agglomerates for use in laundry detergents United States Colgate-Palmolive Co. (New York, NY) 4767546 http://www.freepatentsonline.com/4767546.html
- Patent : Ramachandran, Pallassana N. (Robbinsville, NJ), Peterson, Kenneth S. (Keasbey, NJ) 1984 Fabric softening heavy duty liquid detergent containing a mixture of water insoluble soap and clay United States Colgate-Palmolive Company (New York, NY) 4436637 http://www.freepatentsonline.com/4436637.html
- Patent : Storm, Thomas D. (Waterloo, BE), Nirschl, Joseph P. (Fairfield, OH) 1977 Clay-containing fabric softening detergent compositions United States The Procter & Gamble Company (Cincinnati, OH) 4062647 http://www.freepatentsonline.com/4062647.html



Commentaires
Enregistrer un commentaire